Observer la naissance des cristaux
Des scientifiques ont observé et quantifié précisément les paramètres décrivant la dynamique de nucléation de cristaux de sel dans des gouttes en évaporation produites à l’aide d’un dispositif microfluidique.
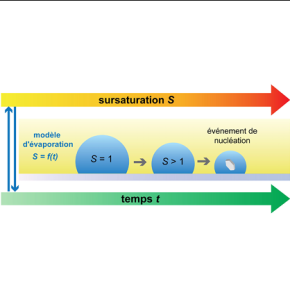
La nucléation est le processus élémentaire correspondant à l'apparition des premiers cristaux nanométriques au sein d'une solution quand la concentration des espèces dissoutes devient trop élevée et que celles-ci précipitent. La compréhension de ce phénomène est essentielle pour des applications telles que la préparation de médicaments, le stockage de l'énergie, la bio-minéralisation et la modélisation du climat. Néanmoins, les mécanismes de la nucléation ne sont pas encore complètement compris à ce jour, à cause notamment de la complexité inhérente au phénomène : la phase solide émergeant doit s’ordonner géométriquement à longue portée à partir d’un réservoir désordonné et soumis aux fluctuations thermiques, un scénario d’autant plus délicat que plusieurs structures cristallines peuvent se retrouver en compétition. Ainsi, les données issues des simulations numériques des cinétiques de nucléation diffèrent parfois de plusieurs ordres de grandeur de celles issues des expériences, quand elles ne se contredisent pas entre elles complètement... Même si ces écarts sont principalement dus au manque de données et/ou aux imprécisions sur les temps de nucléation, ils montrent aussi que la compréhension que nous avons de ce phénomène par nature stochastique est incomplète.
Dans un travail récent, des scientifiques d’une collaboration internationale impliquant le Centre Interdisciplinaire de Nanoscience de Marseille (CINaM, Aix-Marseille Université / CNRS) et le Centre de Physique Théorique (CPT, Aix-Marseille Université / CNRS / Université de Toulon) ont utilisé un montage de microfluidique à base de gouttes saturées en NaCl (le sel de cuisine ordinaire), pour créer des centaines de microgouttelettes de diamètre 10 à 25µm séparées les unes des autres et ayant la même composition. En observant sous microscope en temps réel leur évaporation contrôlée, ils observent très rapidement l'apparition de cristaux de NaCl : la concentration en sel augmentant naturellement dans les gouttes du fait de l’évaporation des seules molécules d’eau, et la solution étant initialement saturée, la solution « expulse » le sel en surabondance en fabriquant un cristal solide qui continue de croître à mesure que l’évaporation se poursuit. En mesurant systématiquement le temps de nucléation de cristal à l’intérieur de chacune des gouttes, les chercheurs ont ainsi accès à une description précise des caractéristiques statistiques de la nucléation, et ces données expérimentales de référence sont comparées aux simulations. La précision de ces expériences permet de mettre en évidence un effet de concurrence intéressant entre le mécanisme de nucléation hétérogène, c’est-à-dire une nucléation du cristal accélérée par la présence de la paroi solide sur laquelle les gouttes sont posées, et les effets de confinement : quand les gouttes maigrissent, la nucléation hétérogène est favorisée, car la proportion de molécules en contact avec la surface solide croît, alors que le confinement va inhiber au contraire la nucléation. Ces résultats sont publiés dans Journal of Chemical Physics.
Références
Référence : CNT effective interfacial energy and pre-exponential kinetic factor from measured NaCl crystal nucleation time distributions in contracting microdroplets, Ruel Cedeno, Romain Grossier, Nadine Candoni, Nicolas Levernier, Adrian Flood, Stéphane Veesler, Journal of Chemical Physics, publié le 16/05/2023.
Doi : 10.1063/5.0143704
Archive ouverte : arXiv