Des cellules vivantes s’orientent à contre-courant à la façon d’un culbuto
Le guidage cellulaire par des signaux chimiques ou physiques est essentiel à de nombreux processus vitaux et repose généralement sur des processus biologiques sophistiqués encore partiellement élucidés. Des physiciens et physiciennes révèlent avec des expériences de microfluidique et une modélisation mécanique que le choix pour les cellules de s’orienter contre ou dans le sens d’un courant peut résulter d’un simple biais physique...
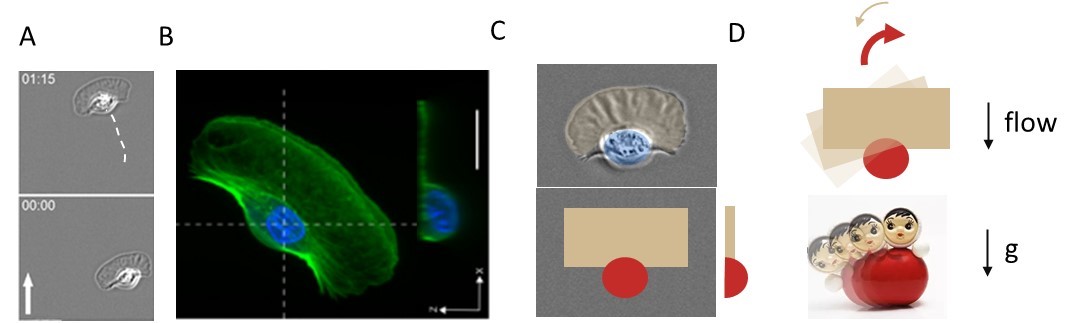
Le guidage de cellules migrantes par divers signaux chimiques et mécaniques repose généralement sur des processus biologiques sophistiqués. Pour le guidage vers des sources chimiques, ou chimiotaxie, les cellules ont des récepteurs moléculaires qui « flairent » la substance d’intérêt et déclenchent des cascades de réactions chimiques intracellulaires qui traitent l’information et réorientent la machinerie de motilité. Pour le guidage par des stimuli mécaniques (la mécanotaxie), par exemple par des gradients de forces, de pression, ou de rigidité de substrat, les mécanismes sont moins bien établis. Des chercheurs du laboratoire Adhésion et Inflammation de Marseille se sont intéressés au phénomène de guidage cellulaire par des forces hydrodynamiques, ou rhéotaxie, qui concernent par exemple les globules blancs ou cellules immunitaires exposées au flux sanguin lors de leur migration sur les parois des vaisseaux sanguins. En collaboration avec une équipe de l’université de Mons, ils ont étudié le guidage sous flux de cellules modèles issues de l’épiderme de poissons, les kératocytes, qui ont l’intérêt d’avoir une grande stabilité de forme et de direction. Ils ont montré que sous flux, chaque cellule adopte une orientation (et donc un sens de migration) propre vers l’amont ou vers l’aval (voir figure A), et que cette orientation intrinsèque résulte de l'interaction mécanique de l'écoulement avec la morphologie des cellules.
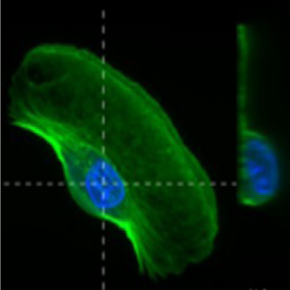
Les kératocytes ont un « avant » large et plat, le lamellipode, tandis que leur « arrière » est compact et protubérant car il contient le noyau et les organelles (voir figure B, partie droite). Un modèle simplifié de cellule avec un pôle arrière hémisphérique et un pôle avant plat rectangulaire (voir figure C) permet de calculer quantitativement les forces que le courant exerce sur chaque pôle. Ces forces sont négligeables par rapport à la force motrice des cellules si bien que la vitesse des cellules n’est nullement affectée par le flux. En revanche, le fait que ces forces s’exercent sur deux pôles morphologiquement différents induit une force de rotation sur les cellules. Cette force stabilise les cellules qui ont un pôle arrière volumineux face au flux, à la façon d’un culbuto qui reste debout du fait de son pôle inférieur pesant. Le modèle des chercheurs a prédit avec succès l’orientation observée expérimentalement pour chaque cellule, soit dans le sens du courant, soit à l’opposé, montrant que la morphologie des cellules est suffisante pour prédire leur orientation. Le scénario proposé, qui ne dépend pas de la nature des cellules, est aussi opérationnel pour les globules blancs lorsqu’ils migrent avec ou contre le flux sanguin sur les parois des vaisseaux sanguins.
Ce travail interdisciplinaire, mené par des physiciennes et des physiciens du laboratoire Adhésion et inflammation (LAI, Aix-Marseille/CNRS/INSERM) en collaboration avec l'Université de Mons, apporte le regard du physicien sur un phénomène d’orientation cellulaire sous flux, ou rhéotaxie. C’est un exemple élégant où un comportement biologique caractérisé ne résulte pas de détecteurs moléculaires spécialisés et d’une cascade complexe de biosignalisations internes pour réorienter la cellule, mais d’un simple biais physique passif. Il est publié dans la revue Proceedings of the National Academy of Sciences (PNAS).
Pour aller plus loin
Référence
Keratocytes migrate against flow with a roly-poly-like mechanism.Valentine Seveau de Noray, Fabio Manca, Inès Mainil et Olivier Theodoly. Publié le 21 novembre 2022, PNAS.
DOI : 10.1073/pnas.2210379119.